Come da precedenti news, il 17 ottobre 2023, è entrato in vigore il Regolamento 2023/2055 concernente la restrizione d’uso delle microplastiche intenzionalmente aggiunte come ingredienti in svariati tipi di prodotti, tra cui anche i prodotti cosmetici.
Cosmetics Europe e l’associazione europea dei fornitori di materie prime cosmetiche EFFCI hanno preparato una linea guida per aiutare le Aziende cosmetiche nell’applicazione del regolamento 2023/2055 ed in particolare viene illustrato un cosiddetto “diagramma di flusso decisionale” da utilizzare come guida per capire se un ingrediente possa o meno rientrare nella definizione di microplastica. Il documento ha carattere di linea guida “aperta”, suscettibile di aggiornamenti e revisioni.
Innanzitutto, nella linea guida viene nuovamente esplicitata la definizione di microplastica (microparticelle di polimeri sintetici SPM) ovvero “Polimeri che sono solidi e che sono contenuti in particelle e costituiscono almeno l’1 % in peso di tali particelle, oppure formano un rivestimento superficiale continuo sulle particelle, dove almeno l’1% in peso di tali particelle soddisfa una delle seguenti condizioni:
(a) tutte le dimensioni delle particelle sono uguali o inferiori a 5 mm;
(b) la lunghezza delle particelle è uguale o inferiore a 15 mm e il loro rapporto lunghezza/diametro è superiore a 3.”
Nella linea guida viene specificato che sono esclusi da tale definizione, quindi non rientrano nell’ambito di applicazione del Reg 2023/2055:
- I polimeri naturali ovvero polimeri che sono il risultato di un processo di polimerizzazione che è avvenuto in natura, indipendentemente dal processo attraverso il quale sono stati estratti. Quindi sono polimeri naturali sostanze come la gomma Xantana ma, sulla base della definizione non sono polimeri naturali quelli ottenuti, ad esempio, mediante fermentazione (un processo biotecnologico) proprio perché la polimerizzazione non ha avuto luogo in natura.
- Polimeri che hanno una solubilità superiore a 2 g/L, secondo i criteri descritti nell’appendice 16 del Reg.2023/2055 (ad es. il PVP).Le autorità di regolamentazione possono richiedere relazioni di supporto ed i dati devono essere forniti senza ingiustificato ritardo.I metodi di prova consentiti sono il metodo OECD 105 e OECD 120; I test devono essere eseguiti da laboratori conformi a GPL, ISO 17025 o altri standard internazionali accettati dall’ECHA.
- Polimeri senza atomi di carbonio nella loro struttura.
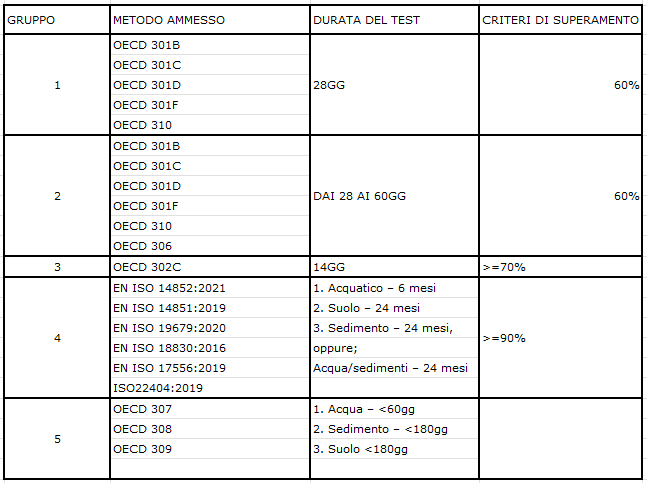
- Polimeri biodegradabili secondo i metodi di prova consentiti, organizzati in cinque gruppi, e descritti nell’appendice 15 del Reg 2023/2055. Le autorità di regolamentazione possono richiedere relazioni di supporto ed i dati devono essere forniti senza ingiustificato ritardo. Le metodologie di prova consentite sono state raggruppate in base al loro endpoint finale. Se si eseguono test dei gruppi 4 e 5, il polimero deve superare un test in ciascuno dei tre compartimenti per essere considerato biodegradabile. I test devono essere eseguiti da laboratori conformi a GLP, ISO 17025 o altri standard internazionali accettati dall’ECHA.
Uso in deroga
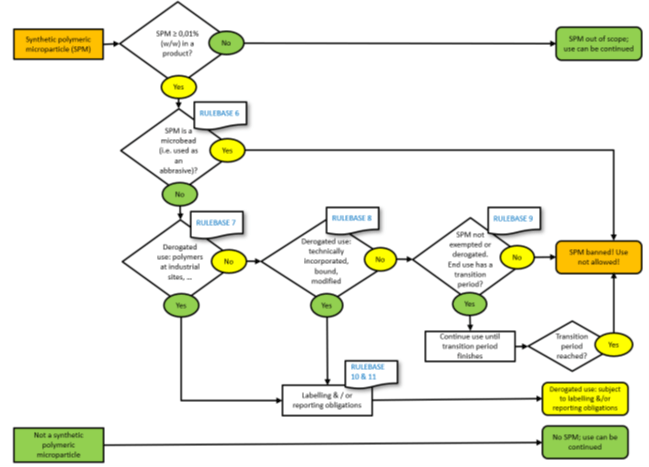
Rientrano nella definizione ma è concesso l’uso in deroga oltre il limite di concentrazione dello 0,01 % per:
A) Le microplastiche usate nei siti industriali. (deroga 4, paragrafo a).
B) Le microplastiche le cui proprietà fisiche vengono modificate in modo permanente* durante la formulazione in un sito industriale. (deroga 4, paragrafo a)
Le aziende possono ricevere SPM da fornitori di materie prime (che hanno obblighi di etichettatura, istruzioni per l’uso e smaltimento). Durante la fabbricazione del prodotto, gli SPM potrebbero non soddisfare più la definizione, ad esempio perché non sono più particelle. L’uso di SPM in queste circostanze è consentito.
Per esempio, un SPM disciolto durante la produzione: le proprietà fisiche vengono modificate in modo permanente e pertanto i polimeri non sono più sotto forma di particelle. Poiché nel prodotto finito non sono presenti SPM, si applica questa deroga.
Vigono degli obblighi informativi all’ECHA entro il 31 maggio 2027 e, successivamente, entro il 31 maggio di ogni anno; i dati riguardano Usi dell’SPM nell’anno solare precedente, informazioni generiche sull’identità e, per ciascun utilizzo, una stima dei rilasci nell’ambiente (compresi i trasporti). Il testo della Restrizione afferma che è responsabilità del primo attore della catena di fornitura (Tutti i produttori e/o importatori e/o utilizzatori a valle in una catena di approvvigionamento) segnalare i dati per evitare una doppia segnalazione.
Saranno però necessari ulteriori chiarimenti su come funzionerà nella pratica.
C) Le microplastiche dove non vi è rilascio nell’ambiente durante l’uso perché contenuti con mezzi tecnici. (deroga 5, paragrafo a).
D) Le microplastiche le cui proprietà fisiche vengono modificate in modo permanente (da notare che le metodologie di test per dimostrare le proprietà fisiche dell’SPM sono state modificate in modo permanente non sono elencate nelle appendici del Reg.) durante l’uso finale da parte del consumatore finale. (deroga 5, paragrafo b).
Questa deroga riguarda scenari in cui il prodotto finito immesso sul mercato contiene SPM, ma viene modificato in modo permanente durante l’uso da parte del consumatore, ad esempio fondendosi in una pellicola durante o dopo l’applicazione.
Se durante l’utilizzo del prodotto da parte del consumatore o dell’utente finale professionale gli SPM cessano di soddisfare la definizione ovvero cambiano dimensione e/o forma, non sono limitati allo 0,01%. Ad esempio, ciò potrebbe verificarsi perché gli SPM formano una pellicola, oppure perché il polimero si rigonfia, modificando dimensione e/o forma durante l’uso.
Questi prodotti devono essere etichettati con le istruzioni per l’uso e lo smaltimento (IFUD). Lo scopo dell’IFUD è prevenire il rilascio di particelle non modificate nell’ambiente. Nel caso dei cosmetici, la loro normale destinazione d’uso porterà alla modifica permanente, pertanto, secondo l’interpretazione di Cosmetics Europe, le Istruzioni per Utilizzo non sono richieste ma lo sono le istruzioni per lo smaltimento che si applicano per prevenire il rilascio di SPM non modificato nei residui del prodotto non utilizzato. Cosmetics Europe raccomanda che l’IFUD contenga il messaggio “Non risciacquare l’imballaggio prima dello smaltimento’, utilizzando il seguente pittogramma:

Alcune precisazioni:
- Non è necessario aggiungere l’IFUD agli imballaggi sigillati come gli aerosol dove non vi è alcuna possibilità che il consumatore acceda al residuo. Tuttavia, gli obblighi si applicano anche laddove vi sia una piccola apertura, come ad esempio nel mascara
- Il pittogramma può trovarsi sull’imballaggio secondario o primario oppure sul foglio illustrativo
- Il pittogramma dovrebbe apparire nell’area in cui vengono comunicate le altre informazioni di “fine vita”. Può essere integrato (ma non sostituito) con mezzi digitali
- In questa fase si tratta solo di una raccomandazione di Cosmetics Europe e non è stata formalmente approvata dalla Commissione
E) Le microplastiche permanentemente incorporate in una matrice solida al momento dell’uso. (deroga 5, paragrafo c)
Per i prodotti che ricadono nelle deroghe 5 a,b,c vigono degli obblighi informativi all’ECHA entro il 31 maggio 2027 e, successivamente, entro il 31 maggio di ogni anno; i dati riguardano Usi finali dell’SPM, informazioni generiche sull’identità e, per ciascun utilizzo finale, una stima dei rilasci. Il testo della Restrizione afferma che è responsabilità del primo attore della catena di fornitura (Tutti i produttori e/o importatori e/o utilizzatori a valle in una catena di approvvigionamento) segnalare i dati per evitare una doppia segnalazione. Saranno necessari ulteriori chiarimenti su come funzionerà nella pratica.
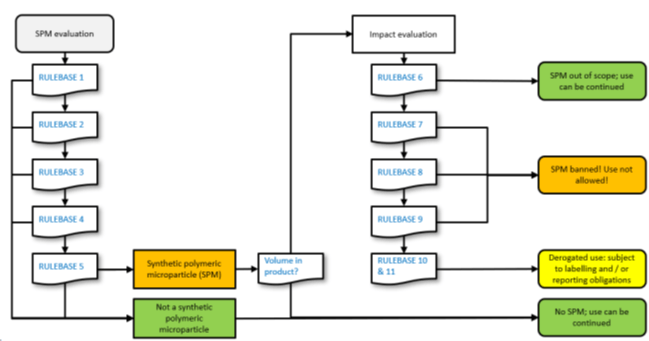
Diagrammi di flusso
I diagrammi di flusso che possono aiutare le aziende nell’identificazione di una sostanza come SPM o meno consistono in un percorso di domande sequenziali che riprendono le definizioni e le deroghe sopra illustrate
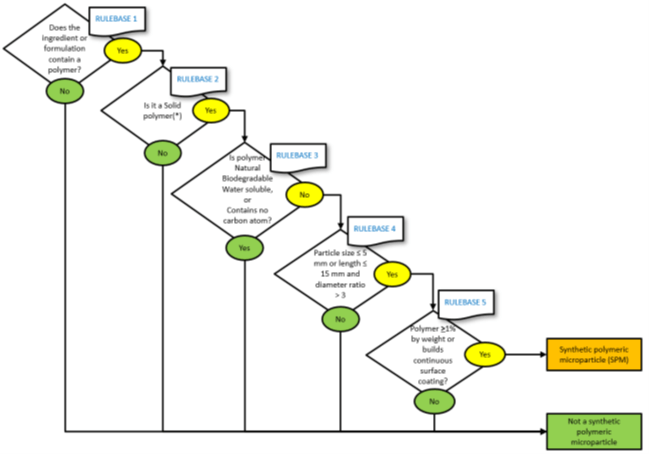
La prima domanda nel diagramma di flusso riguarda la presenza o meno di polimeri nel nostro ingrediente o formulazione:
- Se sì, è necessario passare alla sezione successiva del diagramma di flusso per capire se il polimero soddisfa i criteri stabiliti nella Restrizione
- se no, l’ingrediente o la formulazione non rientrano nell’ambito della restrizione e non sono necessarie ulteriori azioni
I successivi quattro passaggi del diagramma di flusso aiuteranno a determinare se il polimero contenuto nell’ingrediente o nella formulazione è classificato come microparticella di polimero sintetico (SPM).
Al termine di questo primo punto del diagramma di flusso si sarà determinato se la sostanza sia o meno di una SPM.
La parte successiva del diagramma di flusso illustra l’uso delle potenziali deroghe.
Se il prodotto contiene un SPM, ciò che accade dopo dipende dal volume:
- Se l’SPM è presente a meno dello 0,01%, puoi continuare a utilizzare il materiale e non avere ulteriori obbligazioni.
- Se l’SPM è presente in misura maggiore o uguale allo 0,01%, l’uso continuato dipende dal rispetto di una qualsiasi delle deroghe elencate.
Come specificato nelle FAQ presenti nella linea guida non è disponibile alcun elenco di INCI name per gli SPM coperti dalla restrizione.
I periodi di transizione ammessi per abolire le SPM che non rientrano nella esclusione o nell’uso in deroga dai prodotti cosmetici sono i seguenti:
- Microsfere utilizzate in qualsiasi applicazione divieto dal 16 ottobre 2023.
- Prodotti cosmetici rinse-off divieto dal 16 ottobre 2027.
- Prodotti cosmetici leave-on (escluse le applicazioni per labbra, unghie e trucco), fragranze incapsulate utilizzate in qualsiasi applicazione divieto dal 16 ottobre 2029.
- Make up e prodotti unghie divieto dal 16 ottobre 2035 con obbligo, dal 17 ottobre 2031 di inserire in etichetta la frase “Contiene microplastiche” (per i prodotti già presenti sul mercato a quella data l’obbligo di tale indicazione in etichetta parte dal 17 dicembre 2031)
Dalle date sopra indicate scatta il divieto assoluto di immissione sul mercato di prodotti contenenti SPM e, per il Reg. Reach, significa che entro tali date è vietato introdurre nuovi prodotti sul mercato ed è anche vietato continuare a vendere prodotti esistenti che sono già sugli scaffali, ricordiamo infatti che la definizione di immissione sul mercato è diversa da quella del Reg.1223/2009 che solitamente prevede un periodo di vendita.
- VII OMNIBUS ACT, regolamento in bozza
- SCCS: “Scientific Advice on Titanium dioxide (TiO2)”
- Pubblicato Regolamento 1328/2024: Restrizioni su D5e D6
- Opinion preliminare Silver
- Opinion SCCS preliminare sulla tossicità per inalazione dell’ingrediente della fragranza Acetylated Vetiver Oil
- Opinion SCCS preliminare su Citral – Metodologia QRA2 per la sensibilizzazione cutanea
- Opinion SCCS Triphenyl Phosphate Vetiver
- Nuova Regolamentazione UK: BHT e differenze con il Regolamento Europeo 1223/2009
- Reg.2024/996 – Aggiornamento ingredienti cosmetici
- Divieto di greenwashing – Regolamento UE 2024/825
- Regolamento Nanomateriali
- Opinion SCCS Hydroxypropyl p-phenylenediamine
- Congresso Annuale ERPA sulle Normative e Conformità dei prodotti cosmetici
- XXI ATP e Classificazione Sostanze
- Tea Tree Oil, aggiornamento sulla probabile futura classificazione
- NCS – Sostanze Naturali Complesse, allergeni e loro gestione in Dossier Manager
- Microplastiche – regolamento 2023/2055 che modifica l’allegato XVII del regolamento REACH
- Vendita a distanza: regolamento GPSR e linee guida di Cosmetics Europe per i prodotti cosmetici
- Benzophenone-4: Opinon preliminare SCCS
- Sicurezza dell’alluminio nei prodotti cosmetici – SCCS Preliminary Opinion Dicembre 2023 Submission IV
- Francia e la legge AGEC
- Corrigendum SCCS XII
- Aggiornamento su ingredienti D4, D5 e D6
- MoCRA: aggiornamento
- Possibili nuove classificazioni CMR per INCI cosmetici
- Nuovi allergeni (REG. 2023/1545): interpretazione e inserimento componenti dell’essenza in Dossier ManagerMicroplastiche – Regolamento 2023/2055 che modifica l’allegato XVII del regolamento REACHVI OMNIBUS ACT, Reg. 2023-1490 aggiorna l’allegato II del. Reg.1223-2009
- Microplastiche – Regolamento 2023/2055 che modifica l’allegato XVII del regolamento REACHVI OMNIBUS ACT, Reg. 2023-1490 aggiorna l’allegato II del. Reg.1223-2009
- VI OMNIBUS ACT, Reg. 2023-1490 aggiorna l’allegato II del. Reg.1223-2009
- MoCRA: aggiornamenti per la registrazione dei Siti Produttivi e della lista prodotti
- Nuovi allergeni da etichettare
- Regolamento (UE) 2023/988 sicurezza prodotti
- Ingredienti cosmetici: nuove restrizioni entro la fine del 2023
- Aggiornamento microplastiche
- TTC e iTTC
- Interferenti endocrini
- SCCS XII – NAM (New Approach Methodology) & NGRA (Next Generation Risk Assessment)
- Bozza Regolamento sulla restrizione d’uso dei nanomateriali
- HC BLUE 18 – SCCS Opinion
- SCCS XII 16 Maggio 2023
- Classificazione Sostanze, XVIII ATP, Omnibus Act VI – Nuova data entrata in vigore
- Test preliminare tinture per capelli – Raccomandazione CE N.27 del 26/04/2023
- Aggiornamento MoCRA e nuovo portale registrazione prodotti e siti produttivi
- SCCS/1648/22: Preliminary Opinion Hydroxyapatite (nano)
- FDORA 2022 e il Modernization of Cosmetics Regulation Act: aggiornamenti normativi per gli Stati Uniti d’America
- Retinol
- Nuova Opinion SCCS: Triclosan e Triclocarban
- Titanium Dioxide
- Aggiornamento ingredienti: BHT,Homosalate, Resorcinol, Acid yellow 3, HAA229
- Omnibus Act V definitivo
- Etichette cosmetici: nuovi allergeni da dichiarare
- Aggiornamento allegato V al Reg.1223-2009: i conservanti cessori di formaldeide
- Nuovo modulo per la comunicazione delle informazioni sui siti di produzione dei cosmetici
- DIHYDROXYACETONE
- 4-Methylbenzylidene camphor (4-MBC) e nuove restrizioni entro la fine dell’anno
- Classificazione sostanze, XVIII ATP
- Ominbus Act V-XVII ATP
- Opinion SCCS Kojic Acid 17 marzo
- NUOVA RESTRIZIONE IN ALLEGATO III: regolamento (UE) 2022/135 della commissione del 31 gennaio 2022
- Omnibus Act IV
- ALLERGENI nelle fragranze, ultime NOVITÀ di etichettatura per i prodotti cosmetici
- Classificazione sostanze, XVII ATP
- Omnibus Act III
- SCCS XI: Revisione del rischio inalatorio
- SCCS XI: tutte le novità salienti della undicesima revisione delle linee guida per la valutazione della sicurezza degli ingredienti cosmetici
- Archivio Preparati Pericolosi: disattivazione caricamento massivo di notifiche il 20 maggio 2021
- ALLERGENI nelle fragranze, ultime NOVITA’ di etichettatura per i prodotti cosmetici
- Etichettatura allergeni: cosa ci dovremo aspettare
- Dettagli Aggiornamento Tecnico-Normativo
- La banca dati SCIP per articoli con sostanze SVHC
- Classificazione sostanze, anticipazione Omnibus Act 2021
- Aggiornamneti su ZINC PYRITHIONE, TITANIUM DIOXIDE e RESORCINOL
- Lilial vietato all’interno dei prodotti cosmetici
- La teofillina esercita effetti anti-età e anti-citotossicità sulla pelle umana ex vivo
- Coloranti per capelli, ad ossidazione e non, ultime novità e qualche riepilogo
- Aggiornamenti Normativi SCCS Alluminio Final Opinion
- TITANIUM DIOXIDE e TITANIUM DIOXIDE(NANO), ultime novità e qualche riepilogo
- Anticipazioni sull’Omnibus act 2020 – analisi allergene
- Business As Usual – Adempimenti DPCM 08/03/202
- ZINC PYRITHIONE, ultime novità e qualche riepilogo
- Come disattivare un’utenza
- La nuova formula Quali-Quantitativa
- Sostanze Tecniche e Impurezze
- Come esportare una formula distinta base
- Come eliminare un articolo con PIF, formule e versioni di specifica associate
- Come esportare l’etichetta di un prodotto
- Generazione blacklist da modelli
- Come modificare l’assorbimento in percentuale del tuo prodotto
- Come calcolare il SED con categorie cosmetiche personalizzate
- Modulo per l’Etichettatura Ambientale degli Imballaggi
- Come inserire dati nelle categorie cosmetiche per il calcolo QTA10
- Come inserire i dati tossicologici
- Come gestire gli allergeni in etichetta
- Le categorie cosmetiche, strategie di selezione e come crearne di nuove
- Come trovare il Contratto di Manutenzione, la Licenza Utente e i moduli attivi
- Come gestire le note predefinite del PIF
- Ho scaricato l’aggiornamento Tecnico Normativo ma non vedo le modifiche applicate
- Avviso sul superamento della soglia di utilizzo prevista per gli INCI contenuti in Allegato III?
- Quali sono le fonti dei nostri aggiornamenti Tecnico – Normativi?
- I nuovi allergeni e la loro gestione in Dossier Manager – il regolamento UE 2023/1545
- Cosmetici per bambini e neonati: è necessario considerare un MOS specifico?
- Come fare il PIF di un prodotto costituito da più prodotti
- Come modificare l’assorbimento in percentuale del tuo prodotto
- Come calcolare il SED inalatorio di tipo 2 del tuo prodotto
- Come calcolare il SED inalatorio di tipo 1 del tuo prodotto
- Dossier Manager 8.6
- Dossier Manager 8.5.2
- Dossier Manager 8.1.5.2
- Dossier Manager 8.1.5
- Dossier Manager 8.1.2
- Dossier Manager 8
- Dossier Manager 7.4
- Release 7.3.6: aggiornamento obbligatorio per il servizio di teleassistenza HelpDesk
- Traduzioni automatiche: aggiorna DM alla 7.3.5
- Le nuove feature di Dossier Manager 7.3

