Il Regolamento, in bozza, riguarda le sostanze classificate come CMR di categoria 1A, 1B o 2 dal Regolamento Delegato (UE) 2020/1182, già in vigore, e dal Regolamento Delegato (UE) 2024/2564, che si applicherà dal 1° maggio 2026
Di seguito le modifiche introdotte:
Acido Perborico e i suoi sali
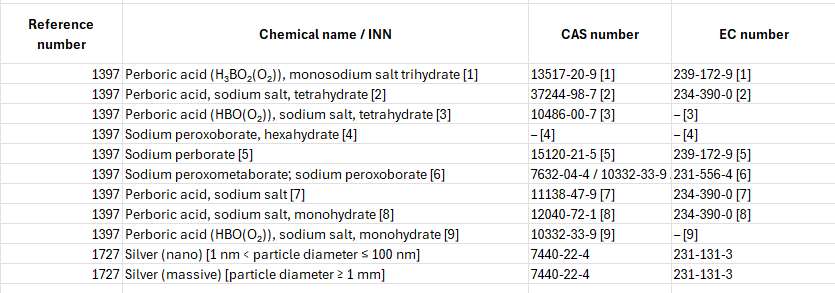
L’acido perborico e i suoi sali, classificati come tossici per la riproduzione di categoria 1B, sono elencati alle voci 1397, 1398 e 1399 dell’Allegato II del Regolamento (CE) n. 1223/2009 e, pertanto, vietati nei prodotti cosmetici. Tuttavia, le sostanze elencate in queste voci sono tutte derivati del perborato, strutturalmente correlati, che condividono un nucleo comune di borato e rilasciano perossido di idrogeno in acqua, determinando proprietà chimiche e attività biologica simili.
Dato il loro meccanismo d’azione comune e i rischi per la salute, è opportuno, dal punto di vista normativo, trattarli come un gruppo anziché come sostanze individuali. Per chiarezza e semplificazione normativa, è opportuno unificare queste voci: la voce 1397 dovrebbe essere modificata per riflettere il contenuto delle voci 1398 e 1399, che dovrebbero essere eliminate.
Argento
L’argento (CAS n. 7440-22-4) è stato classificato come sostanza CMR di categoria 2 (tossico per la riproduzione) dal Regolamento Delegato (UE) 2024/2564, a seconda del diametro delle particelle (argento massiccio ≥ 1 mm, polvere d’argento tra 100 nm e 1 mm, argento nano tra 1 nm e 100 nm).
L’argento è attualmente elencato alla voce 142 dell’Allegato IV del Regolamento (CE) n. 1223/2009 come colorante autorizzato (CI 77820), mentre la sua forma colloidale nano (1-100 nm) è vietata (voce 1727 dell’Allegato II).
È stata presentata una richiesta di esenzione per l’uso dell’argento particolato micronizzato nei cosmetici, ai sensi dell’articolo 15, paragrafo 1.
Il Comitato Scientifico per la Sicurezza dei Consumatori (SCCS) ha concluso che l’argento micronizzato è sicuro in determinate condizioni d’uso nei prodotti cosmetici (parere SCCS/1665/24).
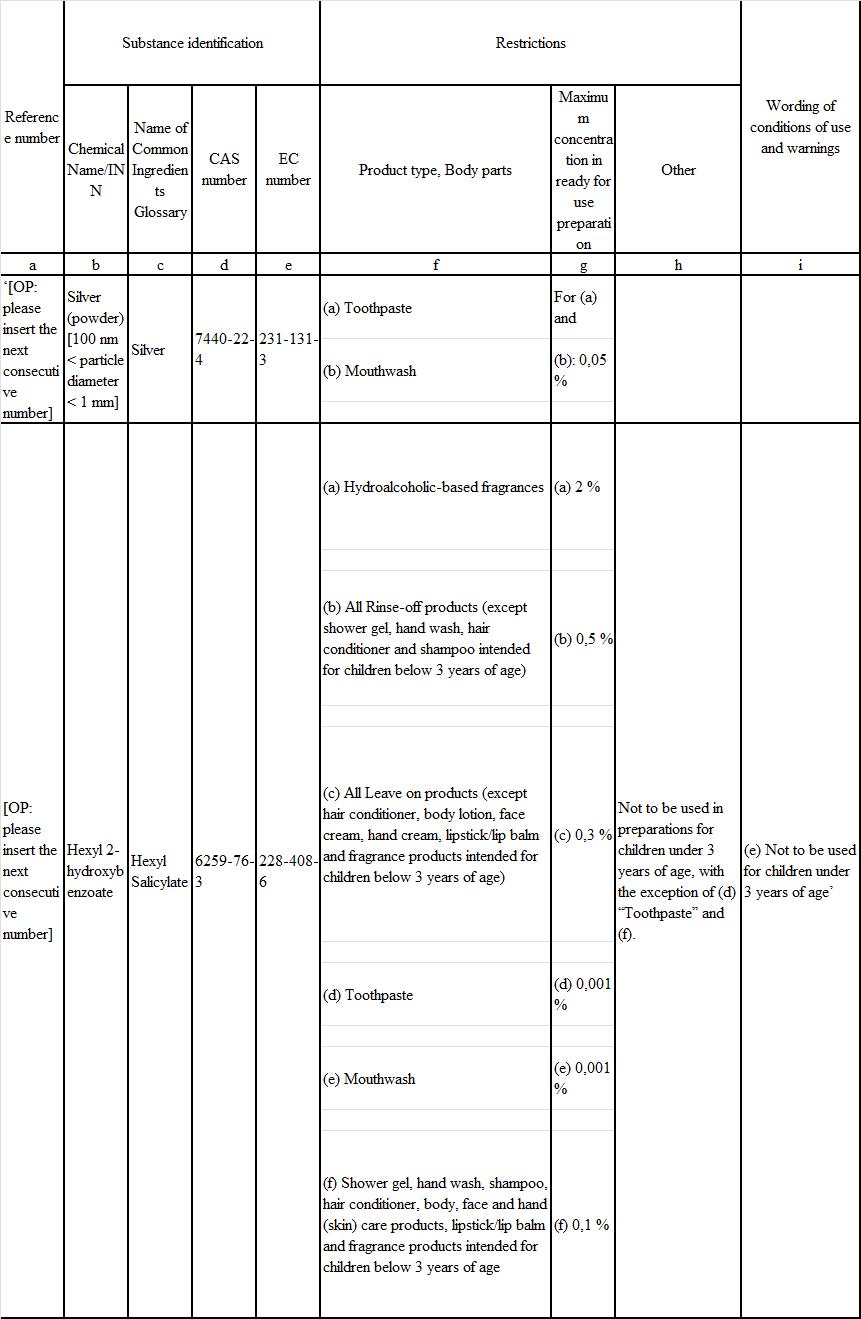
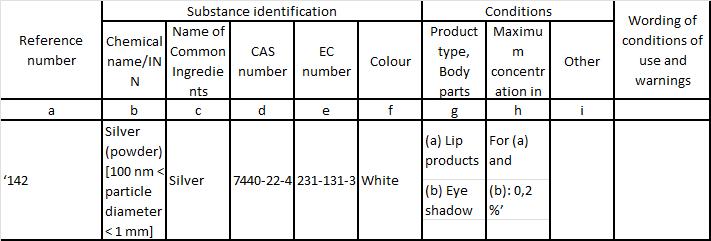
Considerata la classificazione dell’argento massiccio, della polvere d’argento e dell’argento nano come sostanze CMR di categoria 2, l’esenzione richiesta e il parere dell’SCCS, la voce 1727 dell’Allegato II deve essere modificata per includere l’argento massiccio e l’argento nano. Inoltre, la voce 142 dell’Allegato IV deve essere modificata per consentire l’uso della polvere d’argento solo in condizioni sicure, e la sostanza deve essere aggiunta all’elenco delle sostanze con restrizioni dell’Allegato III.
Hexyl salicylate
La sostanza “hexyl 2-hydroxybenzoate” (CAS n. 6259-76-3) è stata classificata come sostanza CMR di categoria 2 (Tossica per la riproduzione) tramite il Regolamento Delegato (UE) 2024/2564.
L’hexyl 2-hydroxybenzoate, con nome INCI “Hexyl Salicylate”, attualmente non è regolamentato dal Regolamento (CE) n. 1223/2009.
Per l’Hexyl Salicylate è stata presentata una richiesta di applicazione dell’Articolo 15(1), del Regolamento (CE) n. 1223/2009 riguardante il suo utilizzo nei prodotti cosmetici.
SCCS, nel parere SCCS/1658/23, ha concluso che l’Hexyl Salicylate può essere considerato sicuro a determinate condizioni d’uso nei prodotti cosmetici. Alla luce della classificazione dell’Hexyl Salicylate come sostanza CMR di categoria 2 e del parere definitivo del SCCS, l’Hexyl Salicylate dovrebbe essere aggiunto all’elenco delle sostanze soggette a restrizioni nei prodotti cosmetici nell’Allegato III del Regolamento (CE) 1223/2009.
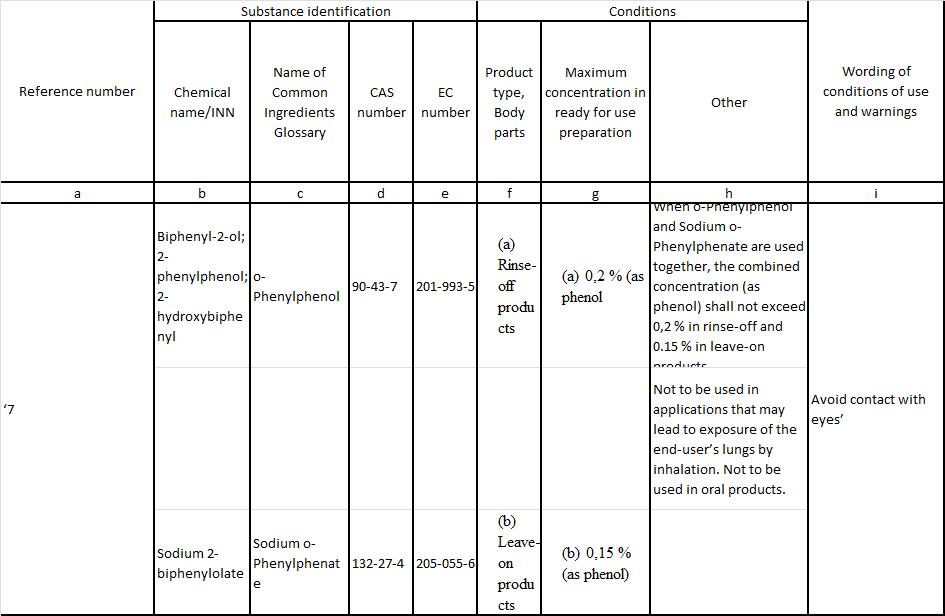
O-Phenylphenol
La sostanza “biphenyl-2-ol” (CAS n. 90-43-7) è stata classificata come sostanza CMR di categoria 2 (Cancerogena di categoria 2) tramite il Regolamento Delegato (UE) 2024/2564.
Il biphenyl-2-ol, con nome INCI “O-Phenylphenol”, è attualmente elencato alla voce 7 dell’Allegato V del Regolamento (CE) n. 1223/2009 come conservante autorizzato nei prodotti a risciacquo e leave-on, con una concentrazione massima consentita rispettivamente dello 0,2% e dello 0,15% (espressa come fenolo).
Per l’O-Phenylphenol è stata presentata una richiesta di applicazione dell’Articolo 15(1), del Regolamento (CE) n. 1223/2009 riguardante il suo utilizzo come conservante nei prodotti cosmetici. Inoltre, il dossier ha incluso la valutazione della sicurezza del “Sodium o-Phenylphenate” (CAS n. 132-27-4), che è il sale sodico dell’O-Phenylphenol e che attualmente non è elencato negli allegati del Regolamento (CE) n. 1223/2009.
SCCS, nel parere SCCS/1669/24, ha concluso che l’O-Phenylphenol e il Sodium o-Phenylphenate possono essere considerati sicuri a determinate condizioni d’uso nei prodotti cosmetici. Alla luce della classificazione dell’O-Phenylphenol come sostanza CMR di categoria 2 e del parere definitivo del SCCS su O-Phenylphenol e Sodium o-Phenylphenate, la voce 7 dell’Allegato V del Regolamento (CE) n. 1223/2009 dovrebbe essere modificata.
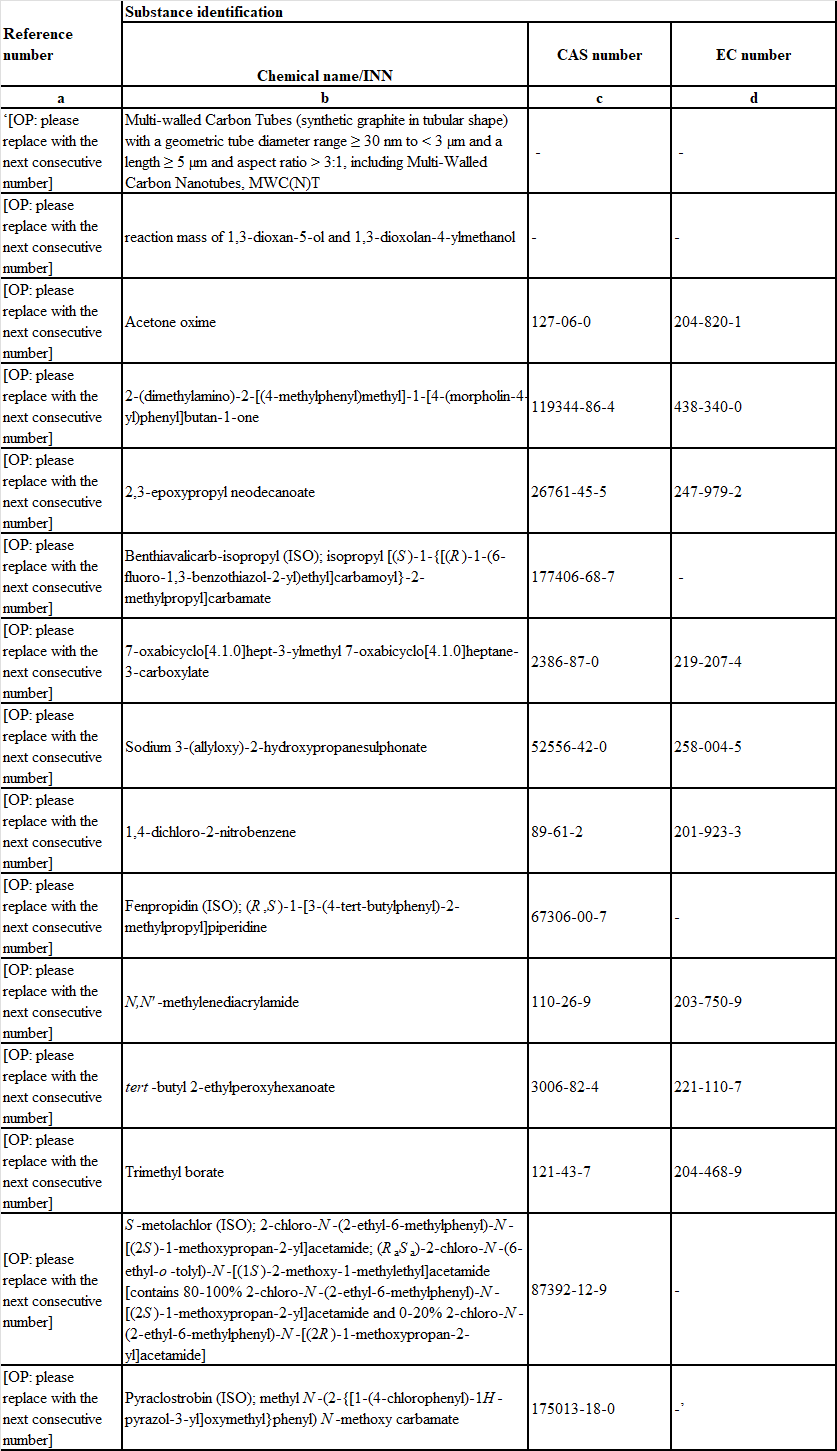
Per tutte le altre sostanze classificate come CMR dal Regolamento Delegato (UE) 2024/2564, non è stata presentata alcuna richiesta di esenzione per l’uso nei cosmetici. Di conseguenza, tali sostanze devono essere aggiunte all’elenco delle sostanze vietate nell’Allegato II.
Il Regolamento (CE) n. 1223/2009 deve quindi essere modificato di conseguenza.
Le modifiche basate sulle classificazioni del Regolamento Delegato (UE) 2024/2564 devono entrare in vigore contemporaneamente alle classificazioni stesse.
La Commissione Europea ha adottato, pertanto, il presente Regolamento:
Articolo 1
Gli Allegati II, III, IV e V del Regolamento (CE) n. 1223/2009 sono modificati come specificato nell’Allegato del presente Regolamento.
Articolo 2
Il presente Regolamento entra in vigore il ventesimo giorno successivo alla sua pubblicazione nella Gazzetta Ufficiale dell’Unione Europea.
Si applica dal 1° maggio 2026. Il presente Regolamento è obbligatorio in tutti i suoi elementi e direttamente applicabile in ciascuno degli Stati membri.
Gli allegati II, III, IV e V del Regolamento (EC) No 1223/2009 sono modificati come segue:
(1) In Allegato II, le voci 1397 e 1727 sono sostituite dalle seguenti:
(2) In Allegato II, le voci 1398 e 1399 sono eliminate.
(3) In Allegato II, le seguenti voci sono state aggiunte:
(4) in Allegato III, le seguenti voci sono state aggiunte:
(5) in Allegato IV, la voce 142 è sostituita come segue:
(6) in Allegato V, la voce 7 è sostituita come segue:
- Omnibus 2
- Semplificazione CPR
- Revisione della Raccomandazione n.26 Cosmetics Europe
- SCCS/1679/25: Final Opinion Benzophenone-2 (BP-2) e Benzophenone-5 (BP-5)
- SAG-CS Opinions su Cessori Formaldeide, Homosalate, 4-Methylbenzylidene Camphor
- SCCS Opinion su Tea Tree Oil e Analoghi delle Prostaglandine
- Richiesta di raccolta dati su phytonadione epoxide (Vitamin K oxide)
- Opinion SCCS sull’esposizione dei bambini dai 3 ai 10 anni all’Acido Salicilico
- SCCS/1674/25: Final opinion on Butylparaben (CAS No. 94-26-8, EC No. 202-318-7) – children exposure –
- Anticipazioni Omibus VIII
- Nuovi Standard ISO per il test dell’SPF
- Regolamento (UE) 2025.40- Imballaggi e rifiuti da imballaggi
- Preliminary Opinion aperta a commenti per Benzophenone-2 e Benzophenone-5
- SCCS/1677/25: Preliminary opinion on Hydroxyapatite (nano), HAP (nano)
- SCCS: presa in carico della valutazione della sicurezza per i coloranti BASIC BROWN 16 e BASIC BLUE 99
- Regolamento Deforestazione non interessa i prodotti cosmetici
- Preliminary Opinion SCCS DHHB
- Valutazione del regolamento sui prodotti cosmetici – invito a contribuire alla sua valutazione
- Aggiornamento su Regolamentazione UK per le salviette umidificate contenenti plastica
- Final Opinion SCCS HC RED 18
- Confermata Allerta Acido Gliossilico
- Candidate list ECHA, nuove sostanze
- Proposta FDA: standardizzazione dei test per la rilevazione di fibre di amianto nel talco
- Nuova Regolamentazione UK per le salviette umidificate contenenti plastica
- SCCS: Opinion preliminare Ethylhexyl Methoxycinnamate
- Preliminary Opinion SCCS BENZOPHENONE-1
- Opinion finale SCCS Vetiver Oil
- Acido gliossilico, alert dal mercato francese
- Proposta di classificazione per il CBD come sostanza reprotossica
- Talc, aggiornamento sulla probabile futura classificazione
- Classificazione Sostanze XXII ATP
- REGOLAMENTO (UE) 2024/2462: acido perfluoroesanoico (PFHxA), i suoi Sali e sostanze ad esso correlate
- Opinion Finale SCCS su Triphenyl phosphate
- Confermata la sicurezza del colorante HC YELLOW No.16
- Addendum SCCS Opinion sul Hexyl Salicylate
- Esposizione aggregata all’acido salicilico e i suoi esteri nei prodotti cosmetici
- VII OMNIBUS ACT, regolamento in bozza
- SCCS: “Scientific Advice on Titanium dioxide (TiO2)”
- Pubblicato Regolamento 1328/2024: Restrizioni su D5e D6
- Opinion preliminare Silver
- Opinion SCCS preliminare sulla tossicità per inalazione dell’ingrediente della fragranza Acetylated Vetiver Oil
- Opinion SCCS preliminare su Citral – Metodologia QRA2 per la sensibilizzazione cutanea
- Opinion SCCS Triphenyl Phosphate Vetiver
- Nuova Regolamentazione UK: BHT e differenze con il Regolamento Europeo 1223/2009
- Reg.2024/996 – Aggiornamento ingredienti cosmetici
- Divieto di greenwashing – Regolamento UE 2024/825
- Regolamento Nanomateriali
- Opinion SCCS Hydroxypropyl p-phenylenediamine
- Congresso Annuale ERPA sulle Normative e Conformità dei prodotti cosmetici
- XXI ATP e Classificazione Sostanze
- Tea Tree Oil, aggiornamento sulla probabile futura classificazione
- NCS – Sostanze Naturali Complesse, allergeni e loro gestione in Dossier Manager
- Microplastiche – regolamento 2023/2055 che modifica l’allegato XVII del regolamento REACH
- Vendita a distanza: regolamento GPSR e linee guida di Cosmetics Europe per i prodotti cosmetici
- Benzophenone-4: Opinon preliminare SCCS
- Sicurezza dell’alluminio nei prodotti cosmetici – SCCS Preliminary Opinion Dicembre 2023 Submission IV
- Francia e la legge AGEC
- Corrigendum SCCS XII
- Aggiornamento su ingredienti D4, D5 e D6
- MoCRA: aggiornamento
- Possibili nuove classificazioni CMR per INCI cosmetici
- Nuovi allergeni (REG. 2023/1545): interpretazione e inserimento componenti dell’essenza in Dossier ManagerMicroplastiche – Regolamento 2023/2055 che modifica l’allegato XVII del regolamento REACHVI OMNIBUS ACT, Reg. 2023-1490 aggiorna l’allegato II del. Reg.1223-2009
- Microplastiche – Regolamento 2023/2055 che modifica l’allegato XVII del regolamento REACHVI OMNIBUS ACT, Reg. 2023-1490 aggiorna l’allegato II del. Reg.1223-2009
- VI OMNIBUS ACT, Reg. 2023-1490 aggiorna l’allegato II del. Reg.1223-2009
- MoCRA: aggiornamenti per la registrazione dei Siti Produttivi e della lista prodotti
- Nuovi allergeni da etichettare
- Regolamento (UE) 2023/988 sicurezza prodotti
- Ingredienti cosmetici: nuove restrizioni entro la fine del 2023
- Aggiornamento microplastiche
- TTC e iTTC
- Interferenti endocrini
- SCCS XII – NAM (New Approach Methodology) & NGRA (Next Generation Risk Assessment)
- Bozza Regolamento sulla restrizione d’uso dei nanomateriali
- HC BLUE 18 – SCCS Opinion
- SCCS XII 16 Maggio 2023
- Classificazione Sostanze, XVIII ATP, Omnibus Act VI – Nuova data entrata in vigore
- Test preliminare tinture per capelli – Raccomandazione CE N.27 del 26/04/2023
- Aggiornamento MoCRA e nuovo portale registrazione prodotti e siti produttivi
- SCCS/1648/22: Preliminary Opinion Hydroxyapatite (nano)
- FDORA 2022 e il Modernization of Cosmetics Regulation Act: aggiornamenti normativi per gli Stati Uniti d’America
- Retinol
- Nuova Opinion SCCS: Triclosan e Triclocarban
- Titanium Dioxide
- Aggiornamento ingredienti: BHT,Homosalate, Resorcinol, Acid yellow 3, HAA229
- Omnibus Act V definitivo
- Etichette cosmetici: nuovi allergeni da dichiarare
- Aggiornamento allegato V al Reg.1223-2009: i conservanti cessori di formaldeide
- Nuovo modulo per la comunicazione delle informazioni sui siti di produzione dei cosmetici
- DIHYDROXYACETONE
- 4-Methylbenzylidene camphor (4-MBC) e nuove restrizioni entro la fine dell’anno
- Classificazione sostanze, XVIII ATP
- Ominbus Act V-XVII ATP
- Opinion SCCS Kojic Acid 17 marzo
- NUOVA RESTRIZIONE IN ALLEGATO III: regolamento (UE) 2022/135 della commissione del 31 gennaio 2022
- Omnibus Act IV
- ALLERGENI nelle fragranze, ultime NOVITÀ di etichettatura per i prodotti cosmetici
- Classificazione sostanze, XVII ATP
- Omnibus Act III
- SCCS XI: Revisione del rischio inalatorio
- SCCS XI: tutte le novità salienti della undicesima revisione delle linee guida per la valutazione della sicurezza degli ingredienti cosmetici
- Archivio Preparati Pericolosi: disattivazione caricamento massivo di notifiche il 20 maggio 2021
- ALLERGENI nelle fragranze, ultime NOVITA’ di etichettatura per i prodotti cosmetici
- Etichettatura allergeni: cosa ci dovremo aspettare
- Dettagli Aggiornamento Tecnico-Normativo
- La banca dati SCIP per articoli con sostanze SVHC
- Classificazione sostanze, anticipazione Omnibus Act 2021
- Aggiornamneti su ZINC PYRITHIONE, TITANIUM DIOXIDE e RESORCINOL
- Lilial vietato all’interno dei prodotti cosmetici
- La teofillina esercita effetti anti-età e anti-citotossicità sulla pelle umana ex vivo
- Coloranti per capelli, ad ossidazione e non, ultime novità e qualche riepilogo
- Aggiornamenti Normativi SCCS Alluminio Final Opinion
- TITANIUM DIOXIDE e TITANIUM DIOXIDE(NANO), ultime novità e qualche riepilogo
- Anticipazioni sull’Omnibus act 2020 – analisi allergene
- Business As Usual – Adempimenti DPCM 08/03/202
- ZINC PYRITHIONE, ultime novità e qualche riepilogo
- Come disattivare un’utenza
- La nuova formula Quali-Quantitativa
- Sostanze Tecniche e Impurezze
- Come esportare una formula distinta base
- Come eliminare un articolo con PIF, formule e versioni di specifica associate
- Come esportare l’etichetta di un prodotto
- Generazione blacklist da modelli
- Come modificare l’assorbimento in percentuale del tuo prodotto
- Come calcolare il SED con categorie cosmetiche personalizzate
- Modulo per l’Etichettatura Ambientale degli Imballaggi
- Come inserire dati nelle categorie cosmetiche per il calcolo QTA10
- Come inserire i dati tossicologici
- Come gestire gli allergeni in etichetta
- Le categorie cosmetiche, strategie di selezione e come crearne di nuove
- Come trovare il Contratto di Manutenzione, la Licenza Utente e i moduli attivi
- Come gestire le note predefinite del PIF
- Esposizione inalatoria nei cosmetici: come calcolarla correttamente secondo SCCS XI?
- Ho scaricato l’aggiornamento Tecnico Normativo ma non vedo le modifiche applicate
- Avviso sul superamento della soglia di utilizzo prevista per gli INCI contenuti in Allegato III?
- Quali sono le fonti dei nostri aggiornamenti Tecnico – Normativi?
- I nuovi allergeni e la loro gestione in Dossier Manager – il regolamento UE 2023/1545
- Cosmetici per bambini e neonati: è necessario considerare un MOS specifico?
- Come fare il PIF di un prodotto costituito da più prodotti
- Come modificare l’assorbimento in percentuale del tuo prodotto
- Come calcolare il SED inalatorio di tipo 2 del tuo prodotto
- Come calcolare il SED inalatorio di tipo 1 del tuo prodotto
- Dossier Manager 8.7
- Dossier Manager 8.6.7
- Dossier Manager 8.6.4
- Dossier Manager 8.6
- Dossier Manager 8.5.2
- Dossier Manager 8.1.5.2
- Dossier Manager 8.1.5
- Dossier Manager 8.1.2
- Dossier Manager 8
- Dossier Manager 7.4
- Release 7.3.6: aggiornamento obbligatorio per il servizio di teleassistenza HelpDesk
- Traduzioni automatiche: aggiorna DM alla 7.3.5
- Le nuove feature di Dossier Manager 7.3

